Jak usunąć toksyny z organizmu: Gen MTHFR i zaburzenia metylacji

Gen MTHFR a zaburzenia metylacji
Coraz więcej osób choruje na alergię, choroby z autoagresji czy choroby nowotworowe.
We wszystkich tych schorzeniach występują zaburzenia w funkcjonowaniu układu immunologicznego: jest on nadaktywny lub zbyt leniwy.
Głównymi winowajcami zaburzeń układu odpornościowego są toksyny a przy współistniejącej predyspozycji genetycznej jesteśmy bardziej narażeni na ich szkodliwy wpływ.
W potocznym użyciu słowa toksyną nazywamy nie tylko trucizny wydzielane przez drobnoustroje, ale też szkodliwe substancje zawarte w dymie spalinowym, chemiczne środki ochrony roślin, metale ciężkie, leki, syntetyczne dodatki do żywności, plastiki, chemiczne środki czystości czy np. składniki farb i lakierów.
Wszystkie te związki mają destrukcyjne oddziaływanie na nasz układ immunologiczny, który jest niezwykle wrażliwym „organem”.
Dlaczego zatem niektóre osoby żyjąc w zanieczyszczonym środowisku nie chorują a inne tak?
Odpowiedzią na to pytanie może być nasza predyspozycja genetyczna do usuwania toksyn z organizmu, za którą odpowiada gen MTHFR. Jego mutacje występują w 4-26% ogólnej populacji (w USA w ok. 50%). W Polsce może występować u ok. 30% populacji (u 50% kobiet).
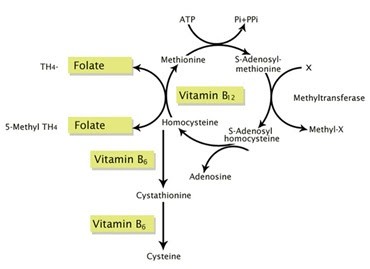
Gen MTHFR koduje enzym – reduktazę metylenotetrahydrofolianu, który bierze udział w procesie przekształcenia toksycznego aminokwasu homocysteiny do metioniny w reakcji katalizowanej przez syntazę metioninową z udziałem kwasu foliowego i witaminy B12.
U osób z mutacją w genie MTHFR stwierdza się podwyższone stężenie homocysteiny we krwi i moczu, szczególnie przy niedoborze kwasu foliowego i/lub witaminy B12.
Może to skutkować zwiększoną kumulacją toksyn w organizmie, skłonnością do zakrzepicy żylnej a u kobiet skłonnością do poronień, w ogóle trudności z zajściem w ciążę i większe ryzyko urodzenia dziecka z zespołem Downa i innymi wadami.
Mówimy w takim wypadku o tzw. zaburzeniach metylacji. Metylacja odpowiada za przekształcenie kwasu foliowego i witaminy B12 do ich aktywnych postaci, które wykorzystuje nasz organizm.
Prawidłowa metylacja jest potrzebna m. in. do:
- detoksykacji (synteza wątrobowego glutationu – nasz najpotężniejszy antyoksydant)
- włączania/wyłączania genów
- leczenia i regeneracji (synteza białka)
- syntezy neurotransmiterów: serotoniny, dopaminy i melatoniny
- tworzenia komórek odpornościowych
- syntezy kwasów nukleinowych
- produkcji energii
- eliminacji histaminy (zapewniając odpowiedni poziom enzymu DAO )
- budowy ścian komórkowych
- zapewnienia szczelności jelit (produkcja zonuliny)
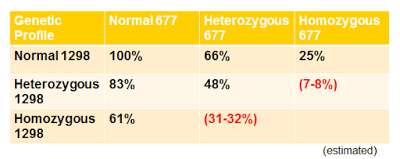
Przy mutacji genu MTHFR (badane allele c677T i A1298c) wszystkie powyższe procesy mogą być zaburzone. Mutacja może spowodować spadek aktywności genu (i możliwość usuwania toksyn) do zaledwie 7%.
W jakich chorobach warto wykonać badanie polimorfizmu MTHFR?
- chorobach autoimmunologicznych
- nowotworach
- alergiach
- chorobach tarczycy
- zespole jelita drażliwego
- chorobach skóry
- miażdżycy
- depresji
- w zaburzeniach snu
- insulinooproności (cukrzyca t. 2)
- w chorobach neurodegeneracyjnych
- u kobiet przy częstych poronieniach
W przypadku osób z mutacją genu MTHFR należy przyjmować kwas foliowy i witaminy z grupy B w odpowiedniej zmetylowanej formie (dawka uzależniona jest od typu mutacji: homo- lub heterozygotycznej).
Niezmetylowane postaci mogą być bardzo szkodliwe.
Trzeba też unikać toksyn w środowisku i żywności oraz zastosować odpowiednią dietę (unikać „marketowego” mięsa, glutenu i nabiału krowiego) i suplementację (np. glutation, selen, probiotyki i inne dobierane indywidualnie na podstawie diagnostyki).
Obniżona skłonność do usuwania toksyn może też wystąpić u osób bez mutacji genu MTHFR, przy niedoborze zwykłego kwasu foliowego i/lub witamin z grupy B.
Warto zatem zbadać ich stężenie w osoczu krwi łącznie z poziomem homocysteiny.
Należny nadmienić , że wysoki poziom homocysteiny oznacza wyższe ryzyko wystąpienia chorób serca w tym zawału.
dr Malwina Taborowska (dietetyk, biolog)
dietetyk-med.pl

























 Kawy, Herbaty, Kakao
Kawy, Herbaty, Kakao Książki
Książki Kosmetyki naturalne, maści
Kosmetyki naturalne, maści Miody i produkty pszczele
Miody i produkty pszczele Witaminy i suplementy
Witaminy i suplementy Zdrowa żywność
Zdrowa żywność Zioła i mieszanki ziołowe
Zioła i mieszanki ziołowe Dla domu
Dla domu